本文只是对网上收集资料的简单整理
当确证某个药物疗效时,优效试验(试验药与安慰剂、试验药的较低剂量或阳性药相比较的优效性)一般是理想选择。当优效试验不适用时,如使用安慰剂对照不符合伦理要求,可考虑采用非劣效试验。非劣效试验是为了确证试验药临床疗效,即使低于阳性对照药,但其差异也是在临床可接受范围之内。
指导原则中提到着重注意以下几点:
- 阳性对照药疗效的既往证据:在充分考虑不同试验结果变异程度的基础上,可以估计出较为可靠的阳性对照药相对于安慰剂的疗效差异,该疗效差异是非劣效试验中用于确定非劣效界值的关键参数
- 恒定假设:对阳性对照药相对于安慰剂的疗效差异估计的证据多源于既往临床试验,应尽可能确保本次非劣效试验中阳性对照药的疗效与既往临床试验保持一致,即满足恒定假设
- 良好的试验质量
之前几篇笔记主要整理了体外诊断试验的一致性评价方法,有人可能认为这个跟药物的生物等效性(bioequivalency , BE )差不多,但我觉得差别还是蛮大的。。。虽然两者都是原研/仿(新研)之间进行比较
一些routine试验一般就是一致性评价试验,但是有些试验的设计还会用到一些其他方法,比如本文想整理的非劣效性评价;说到非劣性,那也得提一下优效性和等效性,这三者的概念如下:
评价一种新的治疗措施的效果往往需要以某已知的有效治疗措施作为参照。如果试验组疗效为A,对照组疗效为B,通常我们会假设A=B,即将A-B与0作比较,这是我们最常用的差异性检验;如果将A-B与一个既定的值Δ进行比较,就产生了一系列检验,如优效、等效、非劣效检验
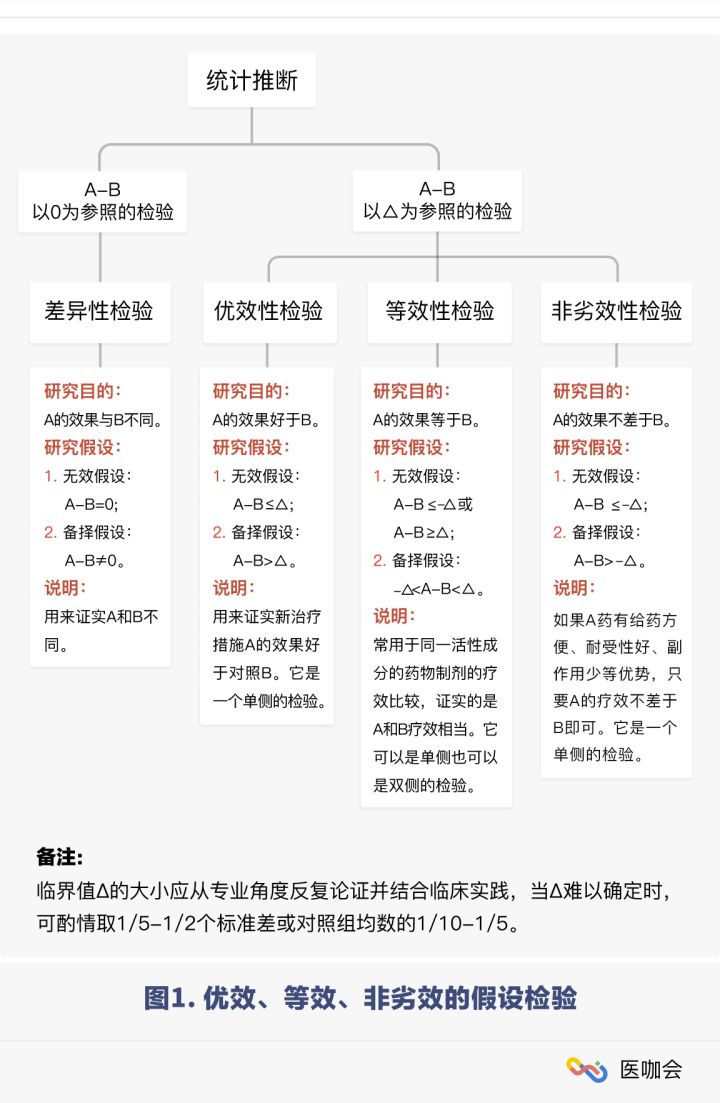
以上参考自:一文搞懂:非劣效性检验是个啥?有何价值?
对于非劣效的临床试验设计方面的在此未做整理,以下只是简单涉及统计分析方法
从上图中可看出,我们一般需要设定一个δ,用于表示一种新研的效果不比标准对照原研的差,那么最低的δ到多少才能算非劣效(noninferiority)呢?这一般需要结合临床意义来设计
δ是一个有临床意义的值,该值的选定至关重要。若δ选大了,将把药效达不到要求的药物判断为非劣效或等效而推向市场;若δ选小了,则可能会埋没一些本可推 广使用的药物。这一数值不应大于安慰剂对照的优效性试验确认有效的效应差值△。一般来说,δ的决定应该由临床学家和统计学家商讨联合做出,而不是单独地依 赖统计学家。注意,选定δ时一定要从临床药效角度,结合以往的试验结果,必要时进行成本效益分析等诸多方面反复论证。δ界值必须在试验的设计阶段决定并在 试验方案中阐明,一旦确定,事后不得随意更改。除非发现新的δ界值比原先选定的δ界值更合理,在揭盲之前可作更正,并在修订方案中陈述理由。一旦揭盲,不得更改。
一般的IVD的临床试验中未有设盲和揭盲,因此这个Δ需要在方案中就事前设定好
所以非劣效界值是指试验药与阳性对照药相比在临床上可接受的最大疗效损失。非劣效界值不应大于阳性对照药相对于安慰剂的临床获益,以确保非劣效试验具有足够的检定敏感性。非劣效界值的确定通常应根据统计分析和临床判断综合考虑,并在试验方案中详细说明非劣效界值的确定过程。
确定非劣效界值的方法主要包括固定界值法和综合法,一般情况下固定界值法更易描述试验药物的疗效。
对于有些试验的Δ难以确定的:
可酌取1/5~1/2个标准差或参比组均数的1/10~1/5。对两组率而言,有人建议Δ最大不应超过对照组样本率的1/5。有作者指出,Δ不能过小,否则,所需的样本含量可能会不切实际。
IVD中,一般不会将临床定量指标作为可接受标准,而是一些定量的统计指标;如以AUC为例,Δ会根据临床意义设定一个标准,如类似于5%
对于评价一个临床试验的终点指标是否满足非劣效,通过会使用非劣效性假设检验(跟等效性检验/优效性检验差不多)
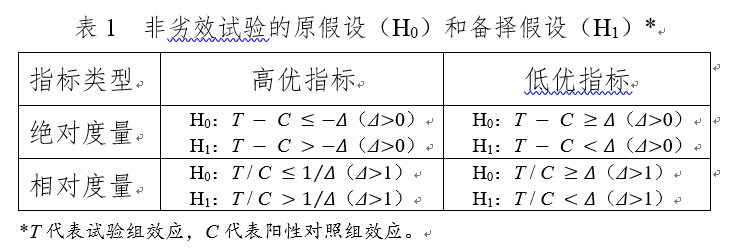
如果试验组终点指标为T,对照组终点指标为C,则非劣性假设检验:
- 原假设(null hypotheses)H0为:T - C ≤ -Δ
- 备择假设(alternative hypotheses)H1为:T - C > -Δ
- 若P值小于等于α,则拒绝原假设,即T非劣效于C
根据指标的实际情况不同,还可以分高优指标和低优指标(乍一看有点懵):
绝对度量指标包括均值差和率差等,相对度量指标包括率比、风险比、比值比等,高优指标是其值越大表明疗效越好的指标,低优指标是其值越小表明疗效越好的指标。
以上的假设检验需要计算Z统计量(z = (d + Δ)/Se),然后再通过Z统计量计算P值即可
实际应用中,更多采用的是可信区间法检验,它是分析时最直接的方法,而且比假设检验提供更多的信息。非劣效性试验中我们仅关注一个方向的可能 差异,因此试验药与对照药的疗效差异的单侧97.5%(或双侧95%)可信区间应当完全在-Δ值的右侧,即其单侧97.5%(或双侧95%)可信区间的下 限应该大于设定的判断界值-Δ,即[单侧97.5%CI (A-B)的下限 ] >-Δ(或[双侧95% CI (A-B)下限] >-Δ)
对于可信区间法检验可参考固定界值法(我觉得两者表达的意思比较接近。。。)
对于非劣效与优效检验的转换
在非劣效试验方案中可以预先定义非劣效与优效检验的转换,即先进行非劣效检验,如果非劣效结论成立,可进一步进行优效检验,如果优效结论成立,则研究结论为优效;如果优效结论不成立,则研究结论为非劣效。当非劣效结论不成立时,不再进行优效检验,研究结论不支持非劣效。上述过程无需多重性调整。
三臂非劣效设计
为了考察试验药是否非劣效于阳性对照药,还可以考虑包含试验组、阳性对照组和安慰剂组的三臂非劣效设计,前提条件是符合伦理。三臂非劣效设计在检验试验药非劣效于阳性对照药的同时,还可以考察阳性对照药是否优效于安慰剂,从而在临床试验内部建立确切的检定敏感性。因此,在伦理许可的情况下,三臂非劣效设计是确证试验药非劣效于阳性对照药的较理想的试验设计。
以上均为网上资料摘抄(主要是指导原则),若有错误请指正下。。。
参考资料:
非劣效设计临床试验指导原则
临床非劣效性与等效性评价的统计学方法
一文搞懂:非劣效性检验是个啥?有何价值?
生物等效性(BE)相关法规—几个概念
本文出自于http://www.bioinfo-scrounger.com转载请注明出处